Молекула гемоглобина
10 000 атомов, составляющих молекулу гемоглобина, соединены в четыре цепи, каждая из которых представляет собой изогнутую несколько раз спираль. Эта молекула способна изменять свою форму в зависимости от того, связана она с кислородом или нет
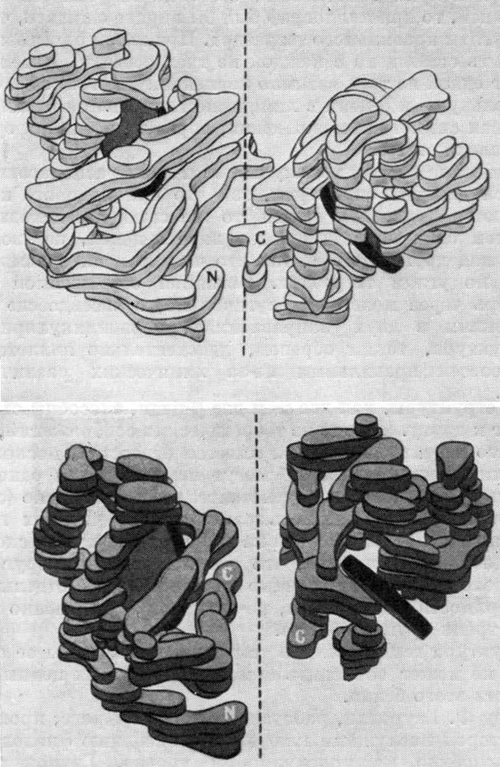
В 1937 году я выбрал темой своей диссертации рентгеноструктурный анализ гемоглобина — белка крови, способного связывать кислород. К счастью, члены Ученого совета, перед которыми я защищал свою диссертацию, не настаивали на определении структуры гемоглобина — иначе мне пришлось бы оставаться аспирантом еще 23 года. Надо сказать, что полностью (вплоть до определения расположения каждого атома в гигантской молекуле гемоглобина) эта проблема не решена еще и поныне. Тем не менее мы уже достаточно знаем о структуре гемоглобина, чтобы представить себе сложную трехмерную конфигурацию из четырех составляющих его цепей, построенных из аминокислотных единиц. Нам известно также положение четырех пигментных групп, содержащих центры связывания с кислородом (смотрите рисунок ниже).
Трехмерная модель молекулы гемоглобина, разработанная
на основании рентгеноструктурного анализа автором и его сотрудниками,
— вид сверху (верхний рисунок) и сбоку (нижний рисунок)

Блоки неправильной формы характеризуют распределение электронных плотностей на разных уровнях молекулы гемоглобина. Молекула состоит из четырех субъединиц: двух идентичных α-цепей (светлые блоки) и двух идентичных β-цепей (темные блоки). Буквой N обозначены концевые аминогруппы α-цепей и буквой С — концевые карбоксильные группы. Каждая цепь окружает группу гема (темный диск) — содержащую атом железа структуру, которая связывает кислород.
Оказалось, что по характеру свертывания четыре цепи гемоглобина очень сходны с одиночной цепью миоглобина — мышечного белка, связывающего кислород. Структуру миоглобина, вплоть до расположения каждого атома в его молекуле, выяснил мой коллега Дж. Кендрью со своими сотрудниками. Совпадение структуры этих двух белков позволяет нам, применяя чисто физические методы, весьма точно установить расположение каждой аминокислотной единицы в местах изгибов и поворотов цепей гемоглобина.
Однако для того, чтобы детально выяснить расположение всех аминокислот в молекуле гемоглобина, — а всего их 20 различных видов,— одних физических методов недостаточно. Здесь на помощь пришел химический анализ.
Американские и немецкие ученые определили последовательность свыше 140 аминокислотных остатков в каждой из четырех цепей гемоглобина. Результаты, полученные благодаря использованию всей совокупности физических и химических методов, позволяют нам сейчас представить себе с большой точностью многие участки молекулы этого белка.
«Молекулы и клетки», под ред. Г.М.Франка

Самым неожиданным оказалось расположение четырех групп гема в молекуле оксигемоглобина. Исходя из характера их химического взаимодействия, следовало бы ожидать, что они лежат рядом друг с другом. На самом же деле каждая группа гема располагается в отдельном углублении на поверхности молекулы и, по-видимому, совершенно не связана с остальными тремя группами гема. Итак, структура гемоглобина в том…

Положение же двух α-цепей, насколько мы могли судить, не изменилось, как и расстояние между атомами железа в β- и их ближайшими соседями в α-цепях. Создавалось впечатление, что две β-цепи раздвинулись, оторвавшись друг от друга, причем их точки соприкосновения с α-цепями несколько изменились. Смотрите рисунок - Сравнение участков двух β-цепей в «восстановленном» (свободном от кислорода) гемоглобине…

Сравнение аминокислотных последовательностей в молекулах гемоглобина и миоглобина у всех изученных видов показало, что только в 15 положениях (то есть не более чем в 1 из 10) стоят одинаковые аминокислотные остатки. Во всех же остальных положениях в процессе эволюции произошло одно или даже более замещений (смотрите рисунок ниже). Последовательность аминокислот в положениях 81 —102 для…

Недавно мне удалось построить модели α- и β-цепей гемоглобина; оказалось, что по своей атомной структуре они очень напоминают миоглобин. Если какие-либо две белковые цепи так похожи друг на друга, то мы вправе ожидать, что они имеют почти одинаковый аминокислотный состав. Выражаясь языком белковой химии, можно сказать, что в молекулах миоглобинов и гемоглобинов всех позвоночных аминокислоты…

На рентгенограммах кристаллов белков число пятен доходит до сотен тысяч. Для точного определения фазы каждого пятна необходимо тщательно измерить несколько раз его интенсивность (степень почернения) как на рентгенограмме кристалла чистого белка, так и на рентгенограммах кристаллов производных этого белка с тяжелыми атомами, в разных положениях присоединенными к его молекуле. Затем в результаты нужно внести поправки…

Если кристалл неподвижен, то на фотографической пленке, помещенной позади него, будут видны пятна, расположенные по эллипсам. Если же кристалл вращать определенным образом, то пятна появятся по углам правильной «решетки», отражающей расположение молекул в кристалле (смотрите рисунок ниже). Рентгенограмма монокристалла гемоглобина, который вращали при фотографировании Электроны, окружающие центры атомов кристалла, рассеивают падающие на них рентгеновские лучи,…

Гемоглобин — это основной компонент эритроцитов, то есть тех клеток, которые переносят кислород от легких к тканям, а углекислоту — от тканей к легким. В одном эритроците содержится около 280 миллионов молекул гемоглобина. Каждая молекула в 64 500 раз тяжелее атома водорода и состоит примерно из 10 000 атомов водорода, углерода, азота, кислорода и серы;…

Соединяясь с электрически заряженными или с диполярными группами, молекулы воды ослабляют электрическое поле, окружающее эти группы, что приводит к уменьшению так называемой свободной энергии и тем самым к стабилизации внутренней структуры молекулы. В то же время боковые группы таких аминокислот, как лейцин или фенилаланин, состоят только из атомов углерода и водорода. Будучи электронейтральными и лишь…
Э. Блаут установил, что некоторые аминокислоты, например валин или треонин, если они присутствуют в большом количестве, также подавляют образование α-спиралей; это, однако, не относится, по-видимому, в сколько-нибудь заметной степени к миоглобину и гемоглобину. Определить аминокислотную последовательность в белках легче, чем выяснить с помощью рентгеноструктурного анализа их трехмерную структуру; было бы поэтому очень важно научиться предсказывать…

Гемоглобин можно сравнить с кислородным баллоном или, лучше, с молекулярным легким. Две из четырех цепей молекулы способны сближаться и раздвигаться, так что промежуток между ними становится то уже — когда гемоглобин связан с кислородом, то шире — когда кислород освобождается. Структурные изменения, связанные с химической активностью, были известны и раньше — не только для гемоглобина,…
